- A+
下载电子版,链接在文末处!
一、化学反应中能量变化
1、反应热(焓变)
1)、定义:在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量。
2)、符号:ΔH。
3)、常用单位:kJ/mol或kJ·mol-1。
4)、测量:可用量热计测量。
5)、表示方法
吸热反应:ΔH>0;放热反应:ΔH<0。
6)、产生原因
化学反应过程中旧键断裂吸收的能量与新键形成放出的能量不相等,故化学反应均伴随着能量变化。
2、燃烧热和中和热
1)、燃烧热:101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
a、燃烧热是以1 mol物质完全燃烧所放出的热量来定义的,因此在书写表示燃烧热的热化学方程式时,以燃烧1 mol物质为标准来确定其余物质的化学计量数。
2)、中和热:在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时的反应热。
(1)、强酸和强碱的稀溶液发生反应,其中和热是相等的,都约是57.3 kJ·mol-1。
H+(aq)+OH-(aq)= H2O(l) ΔH= - 57.3 kJ·mol-1
(2)、强酸和弱碱或弱酸和强碱的稀溶液发生反应,中和热一般小于57.3 kJ·mol-1,因为弱电解质的电离是吸热的。
(3)、中和反应的实质是H+和OH-结合生成H2O。若反应过程中有其他物质生成(如生成不溶性物质、难电离物质等),这部分反应热不在中和热之内。
3、放热反应和吸热反应
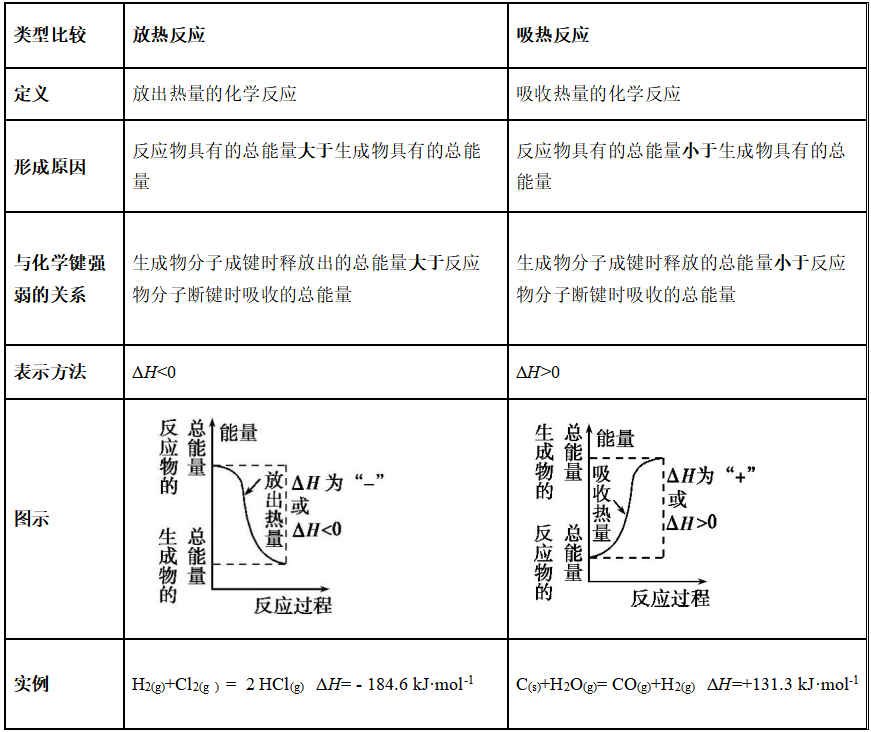
注意:
1)、化学反应表现为吸热或放热与反应开始是否需要加热无关。
需要加热的反应不一定是吸热反应。
例:C+O2= CO2为放热反应
不需要加热的反应也不一定是放热反应。
例:Ba(OH)2·8H2O和NH4Cl的反应为吸热反应。
2)、吸热反应和放热反应均为化学反应。浓硫酸的稀释、NaOH固体溶于水放热,NH4NO3固体溶于水吸热,但它们不属于化学反应,因此不属于吸热反应或放热反应。
二、热化学方程式
1、定义
表示参加反应的物质的量和反应热的关系的化学方程式。
2、表示意义
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
例如:
2H2(g)+O2(g)= 2H2O(l) ΔH= - 571.6 kJ/mol-1
表示25 ℃、101 kPa时,2 mol H2(g)和1 mol O2(g)完全反应生成2 mol H2O(l),放出571.6 kJ的热量。
3、书写要求
1)、注明反应的温度和压强(25 ℃、101 kPa下进行的反应可不注明)。
2)、注明反应物和生成物的状态:固态(s)、液态(l)、气态(g)、水溶液(aq) 。
3)、热化学方程式的化学计量数只表示物质的物质的量,而不代表分子或原子个数,因此可以写成分数。
4)、如果计量数加倍,ΔH也要加倍。
 ”而用“
”而用“  ”表示。
”表示。6)、无论化学反应是否可逆,热化学方程式中的反应热ΔH都表示反应进行到底时的能量变化。
7)、当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
例:
①H2(g)+Cl2(g)= 2HCl(g) ΔH1
②2HCl(g)=H2(g)+Cl2(g) ΔH2
则有:ΔH1 = - ΔH2。
三、盖斯定律
1、内容
不管化学反应是一步完成还是分几步完成,其反应热是相同的,它只与反应体系的始态和终态有关,而与反应途径无关。
2、应用
间接计算某些反应的反应热。
3、计算
例:在1 200 ℃时,天然气脱硫工艺中会发生下列反应:

计算方法:

四、反应热大小的比较
1、直接比较法
依据规律、经验和常识直接判断不同反应的反应热的大小的方法称为直接比较法。
1)、吸热反应的ΔH肯定比放热反应的ΔH大(前者大于0,后者小于0)。
2)、等量的可燃物完全燃烧所放出的热量肯定比不完全燃烧所放出的热量多。
3)、产物相同时,A(g)燃烧放出的热量比等量的A(s)燃烧放出的热量多。反应物相同时,生成B(l)放出的热量比生成等量的B(g)放出的热量多。
4)、生成等量的水时,强酸和强碱的稀溶液反应比弱酸和强碱或弱碱和强酸或弱酸和弱碱的稀溶液反应放出的热量多。
 2SO3(g) ΔH= - 197 kJ/mol,则向密闭容器中通入2 mol O2(g)和1 mol O2(g),反应达到平衡后,放出的热量要小于197 kJ。
2SO3(g) ΔH= - 197 kJ/mol,则向密闭容器中通入2 mol O2(g)和1 mol O2(g),反应达到平衡后,放出的热量要小于197 kJ。2、盖斯定律比较法
1)、同一反应的生成物状态不同时
A(g)+B(g)=C(g) ΔH1<0
A(g)+B(g)=C(l) ΔH2<0
C(g)=C(l) ΔH3<0
因为 ΔH3=ΔH2-ΔH1 < 0
所以ΔH2<ΔH1。
也可以按以下思路分析:
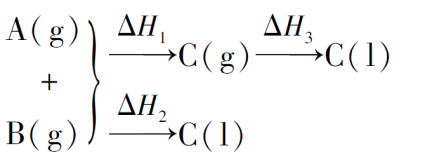
ΔH1+ΔH3=ΔH2,ΔH1<0,ΔH2<0,ΔH3<0
所以ΔH2<ΔH1。
2)、同一反应的反应物状态不同时
S(g)+O2(g)=O2(g) ΔH1<0
S(s)+O2(g)=SO2(g) ΔH2<0
S(g)=S(s) ΔH3<0
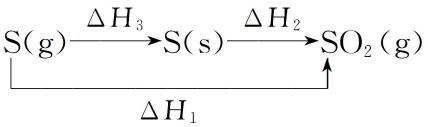
- ΔH2+ΔH3=ΔH1,ΔH1<0,ΔH2<0,ΔH3<0,所以 ΔH1<ΔH2。
往期回顾,一键直达
- 我的微信
- 微信扫一扫
-

- 我的微信公众号
- 微信公众号扫一扫
-







