- A+
下载电子版,链接在文末处!
[h2title]一、氮气的性质[/h2title]
通常情况下,N2无色无味气体,难溶于水,化学性质很稳定,用作保护气,只在高温、放电、催化剂等条件下才能发生一些化学反应。
N2+O2![]() 2NO(自然固氮)
2NO(自然固氮)
N2+3H2![]() 2NH3(人工固氮)
2NH3(人工固氮)
3Mg+N2![]() Mg3N2(淡黄色固体)
Mg3N2(淡黄色固体)
[h2title]二、氮的氧化物[/h2title]
1、NO和NO2
| NO | NO2 | ||
| 物理性质 | 颜色 | 无色 | 红棕色 |
| 毒性 | 有毒 | 有毒 | |
| 溶解性 | 不溶于水 | 溶于水,并与水反应 | |
| 化学性质 | 与O2反应 | 2NO+O2= 2NO2 | — |
| 与H2O反应 | — | 3NO2+H2O= 2HNO3+NO | |
3NO2+H2O= 2HNO3+NO ①
2NO+O2= 2NO2 ②
2*①+② 两式叠加可得:
4NO2+2H2O+O2== 4HNO3
2*①+3*② 两式叠加可得:
4NO+2H2O+3O2== 4HNO3
利用叠加后的方程式,可以最大限度让NO和NO2 被水吸收,转变为HNO3
2、人类活动对自然界氮循环和环境的影响
1)、固氮及影响
a、含义:使空气中游离态的氮转化为化合态氮。
b、方法:自然固氮(雷雨)、人工固氮。
C、影响:酸雨、水华、水体污染。
2)、NOx的污染
a、氮氧化物:有NO、N2O、NO2、N2O3、N2O4、N2O5等,其中NO和NO2是最主要的空气污染物。
b、污染源:石油产品的燃烧和煤的燃烧,汽车尾气及工业废气的排放,农田土壤及动物排泄物中含氮化合物的转化等。
c、污染:
光化学烟雾:NOx和碳氢化合物在紫外线的作用下发生一系列的光化学反应,产生有毒的烟雾。
酸雨:NOx排入大气后,与水反应生成HNO2和HNO3,随雨水一起降落,形成酸雨。
[h2title]三、氨和铵盐[/h2title]
1、氨的结构与性质
2)、物理性质:无色、有刺激性气味的气体,密度比空气小,易液化,极易溶于水,可用作制冷剂。
3)、化学性质
(1)、与水反应
 NH3·H2O
NH3·H2O  NH4++OH-
NH4++OH-NH3是中学化学中唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH3。
(2)、与氧气反应(氨的催化氧化)
4NH3+5O2 4NO+6H2O
4NO+6H2O
2、铵盐的性质和NH4+的检验
1)、铵盐的性质
(1)、易溶于水的离子化合物
(2)、与碱反应
NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
(3)、受热分解
NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
(4)、水解反应
 NH3·H2O+H+
NH3·H2O+H+2)、NH4+的检验
(1)、取样品与碱共热,用湿润的红色石蕊 试纸检验产生的气体,观察试纸是否变蓝。
(2)、取样品与碱共热,用蘸有浓盐酸 的玻璃棒检验产生的气体,观察是否有白烟产生。
3、氨气的制法
1)、氨气的实验室制法
(1)、原理:铵盐与碱共热,产生氨气。
实验室常用反应的化学方程式为:
2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)、制取装置:如图所示。
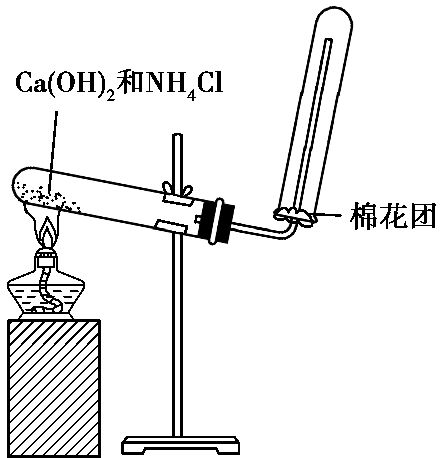
1)、收集:
由于氨气极易溶于水,密度比空气小,所以只能用向下排空气法收集。
2)、检验:
a、用湿润的红色石蕊试纸接近试管口(变蓝);
b、将蘸有浓盐酸的玻璃棒接近试管口(产生白烟)。
3)、棉花团的作用:
在收集NH3的试管口放置一团松软的干棉花,是为了防止试管内的NH3与试管外的空气形成对流,以便在较短时间内收集到较为纯净的氨气。
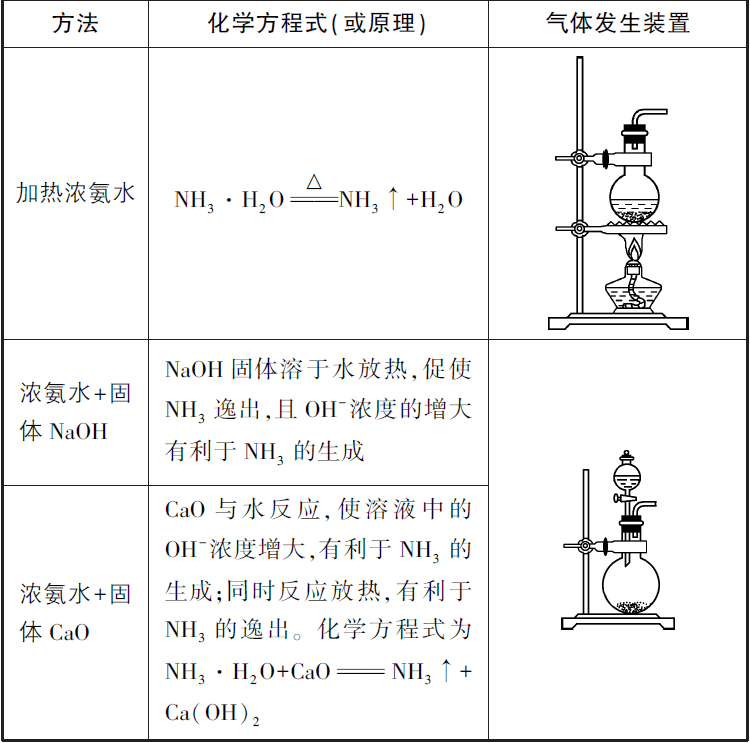
2)、实验室制取氨气的其他方法
3)、氨气的工业制法
N2+3H2![]() 2NH3
2NH3
[h2title]三、氨水的成分及性质[/h2title]
1、组分
三种分子:NH3、NH3·H2O、H2O。三种离子:NH4+ 、OH-、H+
粒子浓度大小顺序为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
2、性质
①容易挥发,浓氨水敞口久置于空气中溶液质量减轻,浓度变小。
②氨水质量分数越大,其密度越小,因此质量分数为x%的氨水与质量分数为3x%的氨水等体积混合后,所得氨水的质量分数小于2x%。
 NH3·H2O
NH3·H2O  NH4++OH- ,氨水呈碱性。
NH4++OH- ,氨水呈碱性。④氨水是很好的沉淀剂,能使Mg2+、Al3+、Fe2+、Fe3+、Ag+、Cu2+、Zn2+转化为氢氧化物沉淀。
[h2title]三、硝酸[/h2title]
1、物理性质
(1)、纯硝酸为无色、有刺激性气味的液体。
(2)、硝酸沸点较低,易挥发,在空气中遇水蒸气形成白雾。
(3)、质量分数在69%以上的硝酸称为浓硝酸。
2、化学性质
(1)、强酸性
稀硝酸能使紫色石蕊溶液变红。
(2)、不稳定性
a、浓硝酸不稳定,见光或受热易分解,反应的化学方程式为:
4HNO3(浓)![]() 2H2O+4NO2↑+O2↑
2H2O+4NO2↑+O2↑
b、存放:浓HNO3应盛放在棕色试剂瓶里,并存放在黑暗阴凉处。
c、浓硝酸常呈黄色是HNO3分解产生的NO2溶于硝酸的缘故,除去硝酸中黄色的方法是通入少量O2,发生的反应为:
4NO2+O2+2H2O= 4HNO3
(3)、强氧化性
a、与金属的反应(大部分金属能与硝酸反应)
Cu与浓、稀硝酸均能反应,化学方程式分别为:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
常温下,铁、铝遇冷的浓HNO3能发生钝化
c、硝酸还能与其他还原剂,如H2S、SO2、Na2SO3、FeSO4、KI、NaBr等发生氧化还原反应。
d、王水
浓HNO3和浓盐酸按体积比1∶3混合即得王水,它的氧化性更强,能溶解Pt、Au等金属。
3、用途
制化肥、炸药、染料等。
往期回顾,一键直达
- 我的微信
- 微信扫一扫
-

- 我的微信公众号
- 微信公众号扫一扫
-







