- A+
下载电子版,链接在文末处!
[h2title]一、铝的性质及应用[/h2title]
1、铝的结构和存在
铝位于元素周期表第三周期ⅢA族 ,原子结构示意图为
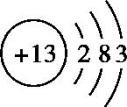
铝元素在地壳中含量丰富,仅次于硅。自然界中的铝全部以化合态形式存在。
2、金属铝的物理性质
铝是银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3、金属铝的化学性质
1)、与非金属单质
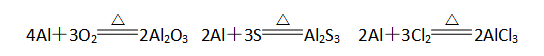
2)、与酸(不与弱酸反应)
①与强氧化性酸(冷的浓硫酸、浓硝酸)发生钝化,表面生成致密氧化膜。
②与弱氧化性酸反应
2Al+6HCl=2AlCl3+3H2↑
3)、与碱(不与弱碱反应)
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
铝既能和酸反应又能与碱反应,所以,铝是两性金属
4)、与某些盐的反应
2Al+3CuSO4=3Cu+Al2(SO4)3
金属性强的置换金属性弱的。
5)、与金属氧化物铝热反应
(1)原理
铝将金属氧化物中化合态的金属还原为金属单质(金属性比铝弱)
例:

(2)实验装置
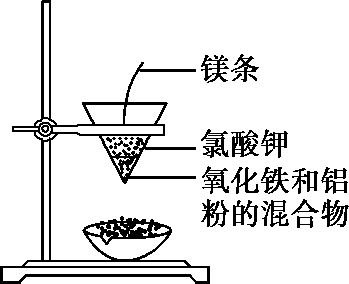
(3)反应现象及结论
[info]镁条剧烈燃烧,放出大量的热,引发混合物剧烈反应,纸漏斗的下部被烧穿,有熔融物落入沙中;待熔融物冷却后,除去外层熔渣,可以发现落下的
是铁珠。[/info]
(4)应用:
[success]
a.野外焊接钢轨;
b.冶炼高熔点金属(金属性比铝弱)。
[/success]
[h2title]二、铝的重要化合物[/h2title]
1、氧化铝
1)、化学性质
[info]
①与酸(强酸)反应
Al2O3+6HCl=2AlCl3+3H2O
②与碱(强碱)反应
Al2O3+2NaOH=2NaAlO2+H2O
氧化铝既能和酸反应又能与碱反应,所以,氧化铝是两性金属氧化物
③熔融通电制备铝单质

[/info]
2)、用途
熔点很高,是一种较好的耐火材料 ,还可制作各种宝石。
2、氢氧化铝
1)、化学性质
①与酸(强酸)反应
Al(OH)3+3HCl=AlCl3+3H2O
②与碱(强碱)反应
Al(OH)3+NaOH = NaAlO2+2H2O
氢氧化铝既能和酸反应又能与碱反应,所以,氢氧化铝是两性金属氢氧化物
③受热易分解
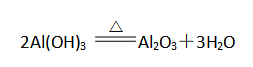
2)、实验室制备
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
[danger]
注意:
不能使用强碱(NaOH)制备氢氧化铝,因为:
AlCl3+3NaOH(少量)=Al(OH)3↓+3NaCl (①)
Al(OH)3+NaOH = NaAlO2+2H2O (过渡方程式) (②)
①+②得:
AlCl3+4NaOH(过量)= NaAlO2+3NaCl+2H2O
若NaOH过量,前期生成得Al(OH)3会继续发生②反应,使得Al(OH)3溶解。氨水是弱碱,即使过量,也不与Al(OH)3反应
[/danger]
3、常见的铝盐
1)、偏铝酸钠(NaAlO2)
[warning]
①与盐酸反应:
NaAlO2+HCl(少量)+H2O=Al(OH)3+NaCl(①)
Al(OH)3+3HCl=AlCl3+3H2O(过渡方程式) (②)
①+②得:
NaAlO2+4HCl(过量)=AlCl3+NaCl+2H2O
由于Al(OH)3可以与强酸反应,因此,过量的HCl与Al(OH)3继续反应,使得Al(OH)3溶解
[/warning]
②与CO2反应:
[info]
2NaAlO2+CO2(少量)+3H2O=2Al(OH)3+Na2CO3 (①)
Na2CO3+CO2+H2O=2NaHCO3(过渡方程式) (②)
①+②得:
NaAlO2+CO2(过量)+2H2O=Al(OH)3+NaHCO3
由于Al(OH)3不与弱酸反应,因此,过量的CO2与Na2CO3继续反应,使得Na2CO3转化成NaHCO3
[/info]
2)、明矾【KAl(SO4)2•12H2O】
[warning]
①电离方程式:KAl(SO4)2 = K++Al3++2SO42-
②应用:净水
③原理:
水解生成氢氧化铝胶体,具有吸附性,能够吸附水中悬浮颗粒,达到净水作用。
[/warning]
往期回顾,一键直达
- 我的微信
- 微信扫一扫
-

- 我的微信公众号
- 微信公众号扫一扫
-







